——藍——
・藍エキスの培養細胞系における抗ウイルス作用(Natual Medicines 53(6), 297-301, 1999)
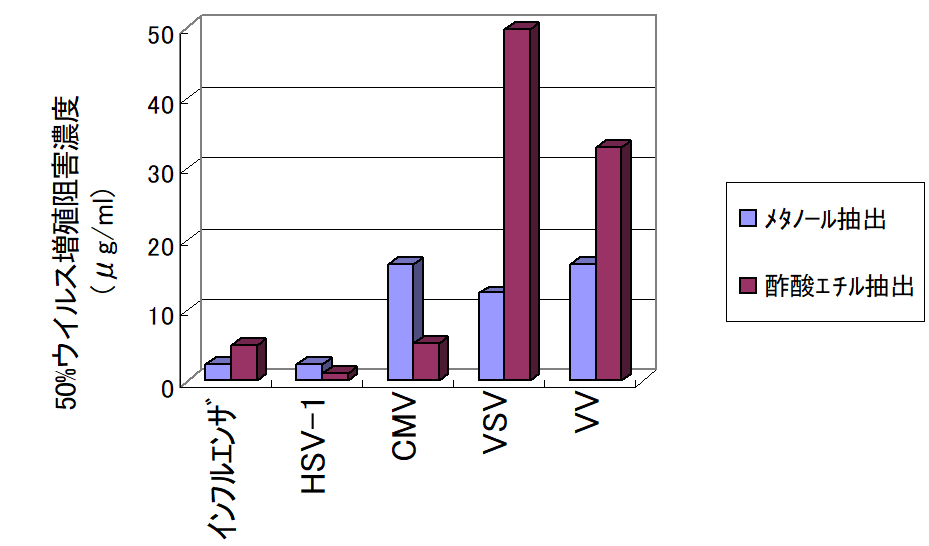
水泡性口内炎ウイルス(VSV)、インフルエンザウイルス、ヒト単純ヘルペスウイルス(HSV-1)、ワクシニアウイルス(VV)、サイトメガロウイルス(CMV)を感染させた培養細胞を用いて、藍抽出エキスの抗ウイルス作用を検討した。 その結果、藍のメタノールおよび酢酸エチル抽出エキスは、ウイルス増殖抑制作用を示した。 また、メタノール抽出エキスをウイルス感染時から作用させた細胞は、培養期間のみエキスを作用させたコントロールに比べて、細胞生存率が向上した。 以上から、藍にはウイルス増殖抑制および感染阻害物質の存在が示され、インフルエンザ等を含むウイルス関連疾患へ効果を示すことが期待された
・藍に含まれる抗ピロリ菌活性を示す物質の単離と同定(Natural Medicines 53 (1), 27-31, 1999)
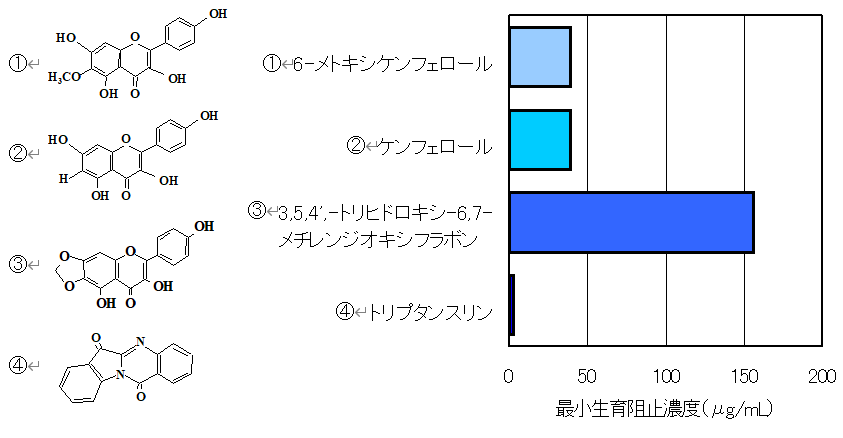
藍抽出エキスには抗ピロリ菌活性があることがわかり、単離、精製を行なった。 その結果、エキス中には6-メトキシケンフェロール、ケンフェロール、3, 5, 4’- トリヒドロキシ- 6, 7-メチレンジオキシフラボン、トリプタンスリンの4種抗ピロリ菌活性を示す化合物を見つけた。これらは2種の臨床分離株を含む4種類のピロリ菌に対して抗菌作用を示した。 以上の結果より、前述の単離化合物あるいは化合物が含まれる藍には、ピロリ菌に対する抗菌、除菌効果、ひいてはピロリ菌が原因となる胃潰瘍などへの応用が期待された。
・藍軟膏のヒトカンジダ症(抗真菌剤で完治させることができない)に対する効果-臨床報告
抗真菌症難治性カンジダ症4例について、藍抽出物は極めて短期間で効果を示した。
カンジダ菌に対する直接的な抗菌作用は弱いことから、好中球やマクロファージ等活性化に伴 う間接的免疫賦活化作用により効果を発揮している可能性が考えられた。
以上のことから藍がカンジダ症を始めとする真菌感染に対して有効であることが示唆された。

・藍に含まれる抗癌物質の検索(Natural Medicines 53(2), 72-79, 1999)
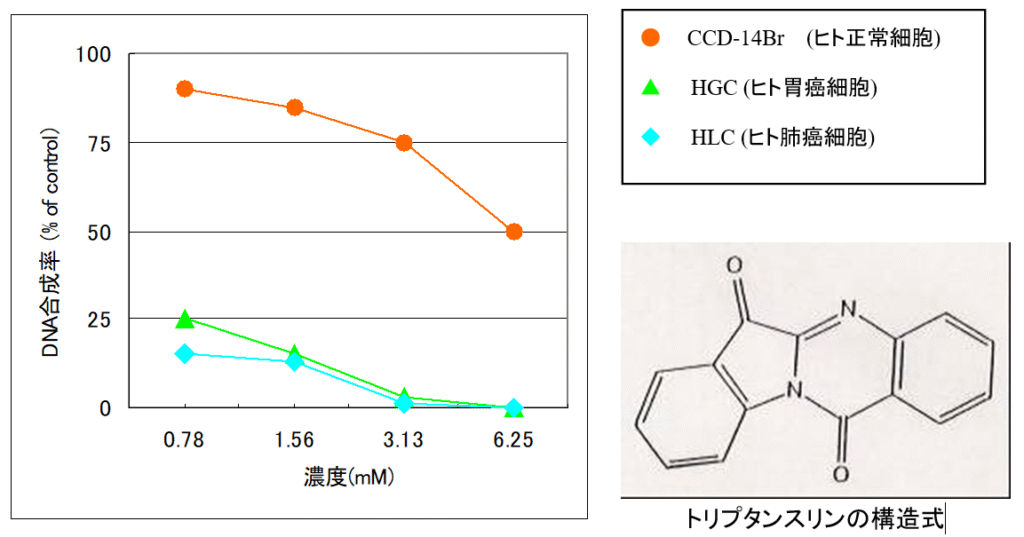
藍抽出エキスをクロマトグラフィーを実施し、細胞傷害活性を分析した結果、活性本体はトリプタンスリンであることがわかった。 トリプタンスリンは各種癌細胞に強い殺癌効果を示すが、正常細胞には傷害が軽度であった。 トリプタンスリン作用機序は、細胞の膨化や空胞化の所見がみられることから、ミトコンドリアの傷害やDNA合成阻害が関与したアポトーシス誘導によるものと考えられた。 以上より、藍には殺癌効果が期待でき、その有効成分のひとつはトリプタンスリンであることが示唆された。
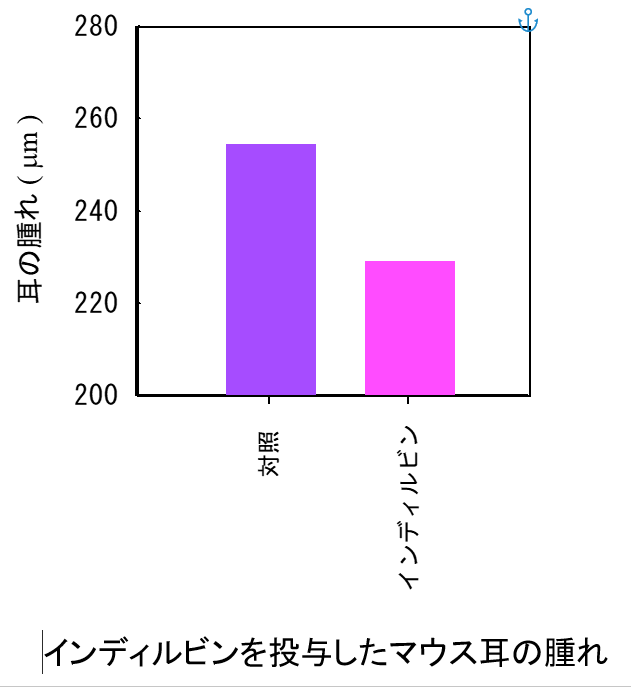
・藍由来成分インディルビンのアレルギー反応抑制作用(European Journal of Pharmacology 410, 93-100, 2000)
藍抽出液から単離されたインディルビンは正常マウス脾臓細胞からのIFN-γ産生を抑制した。 この結果から、さらに金属などの皮膚接触が原因となるアレルギー、接触性過敏症のマウスモデルにて効果を検討した。
その結果、インディルビンは、アレルギー反応から誘発される耳の腫れを有意に抑制することが確認できた。 以上から、インディルビンおよびそれを含有する藍には、接触性の金属アレルギー等に対して有効であることが示唆された。
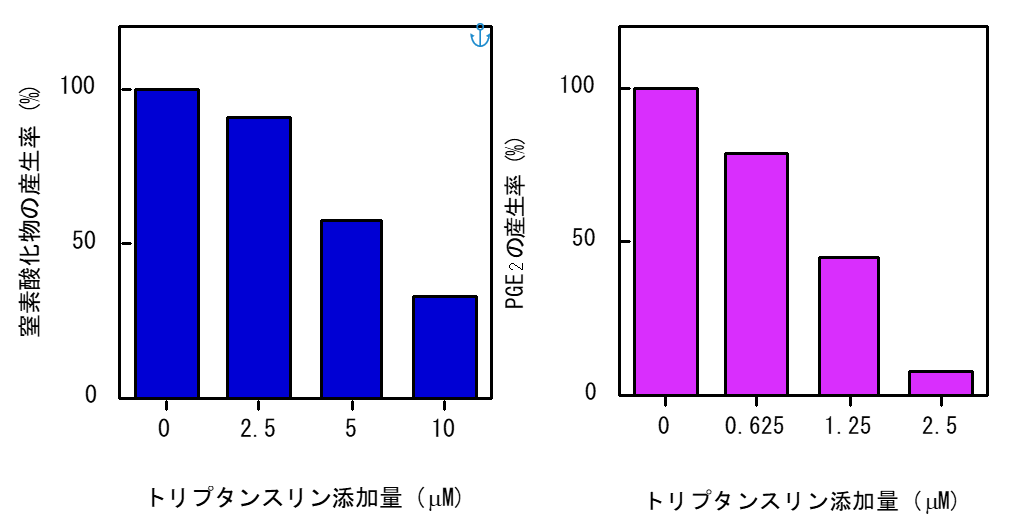
・藍成分のトリプタンスリンの症状緩和に繋がる炎症抑制作用について(European Journal of Pharmacology 407, 197-204, 2000)
トリプタンスリンを、マウスマクロファージ様細胞株に作用させることで、患部の腫れ等原因の窒素酸化物(NO)の産生抑制が確認された。これはNOの合成酵素の量抑制作用であった。
また、痛み原因物質プロスタグランジンE2 産生も、低濃度トリプタンスリン処理により抑制することが確認された。
これは PGE2 産生に関与する酵素 (シクロオキシゲナーゼ) 活性自体への抑制作用によるものであり、NO産生抑制作用とは異なったメカニズムによるものであった。
つまり、トリプタンスリンは複数メカニズムにより抗炎症作用を発揮すると思われる。
また、トリプタンスリンとそれが含有される藍には胃炎、大腸炎等の内臓系炎症疾患や皮膚炎症等を含む広範な症状抑制に対して有効であることが期待される。
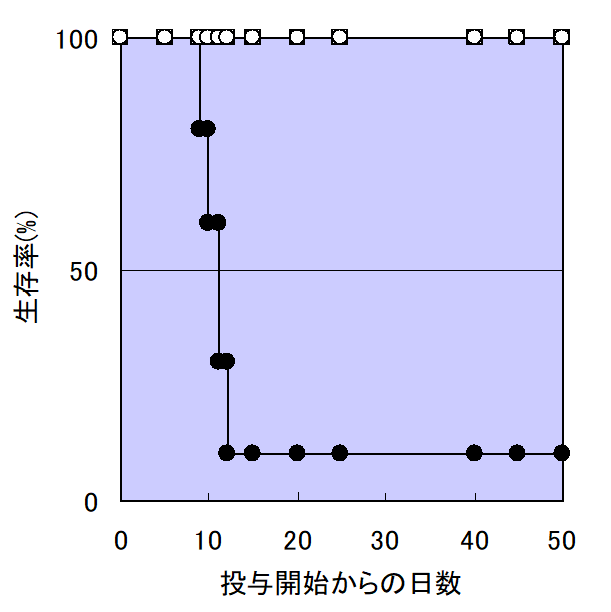
・藍に含まれるトリプタンスリンの経口投与による大腸炎緩和作用(Int. Immunopharmacol. 2, 565-578, 2002)
大腸炎発生マウスにトリプタンスリンを経口投与し、生存率、症状および原因となるサイトカイン産生等について調べた。
その結果、大腸炎発生マウスは、激しい下血や下痢および急激な体重減少を伴う大腸炎の症状を示し、結果的に90%のマウスが死に至った。
しかし、トリプタンスリン投与により、全てのマウスの生存が観察された。
症状原因のサイトカイン産生については、マウスの脾臓細胞からのインターロイキン2(IL-2)の産生抑制が認められた。
以上より、藍に含まれるトリプタンスリンは大腸炎症状緩和に有効である可能性が示唆された。
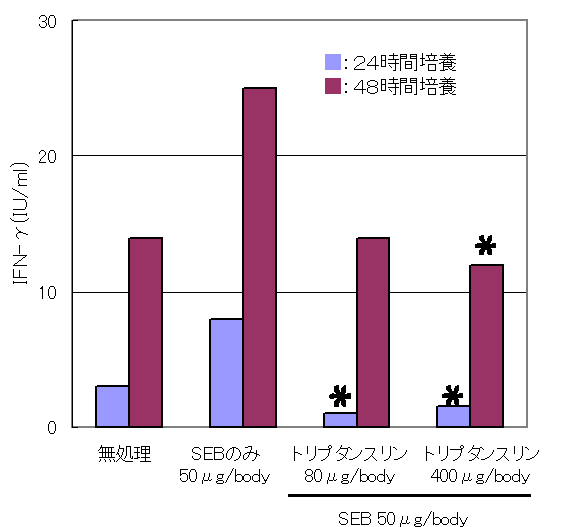
・藍に含まれるトリプタンスリンの経口投与による食中毒緩和作用(Biol. Pharm. Bull. 26(3), 365-367, 2003)
正常マウスの小腸表面に点在するパイエル板からリンパ球を調製し、エンテロトキシン(SEB)にて刺激した。
その結果、食中毒症状原因であるインターフェロンγ(IFN-γ)、インターロイキン2(IL-2)等のサイトカインの過剰産生が認められ、この産生は培養中にトリプタンスリンを添加することによって抑制された。
動物実験においても同様の結果が得られた。
以上より、トリプタンスリンは食中毒の症状緩和に有効である可能性が示唆された。
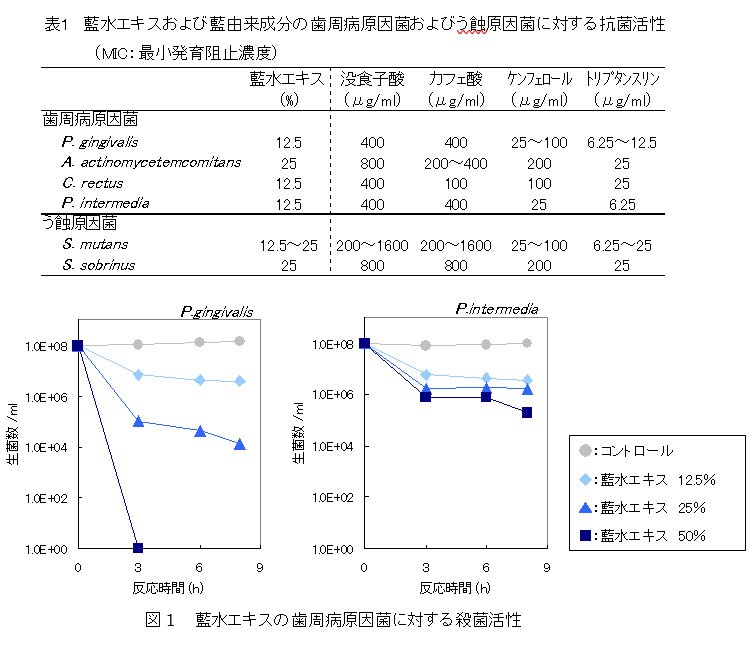
・藍水エキスの口腔内病原菌に対する抗菌活性(Journal of Natural Medicines. 60, 121-125, 2006)
藍水エキスは歯周病原因菌およびう蝕原因菌のいずれに対しても発育阻止作用を示した。
次に、歯周病原因菌に対し、藍水エキスの殺菌活性を調べたところ、藍水エキスは濃度及び時間に依存して殺菌活性を示した。
よって、藍水エキスは歯周病の治療や予防を目的とした有用素材として期待できる。
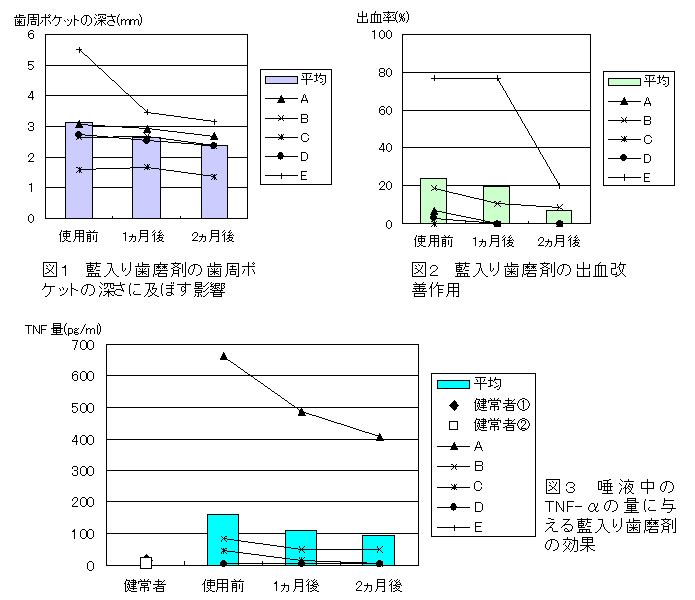
・タデ藍の歯周病治療への応用(日本歯科東洋医学会誌. 25, 7-12, 2006)
藍水エキスを含む歯磨剤を歯周病患者に2ヶ月間使用してもらったところ、歯周ポケットが浅くなり、出血の程度も著しく改善された。
以上の結果から、藍水エキスを含む歯磨剤は歯周病を抑制する作用が明らかとなった。
唾液中の炎症性サイトカインであるTNF-αも有意に減ったことから、藍水エキスの抗炎症作用によるものと思われる。
——プロポリス——
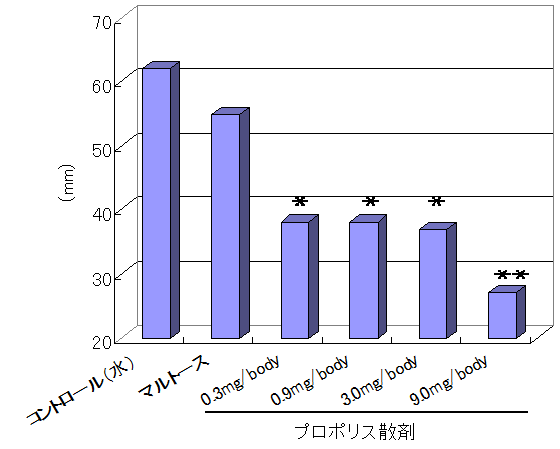
・プロポリス散剤の経口投与による急性胃潰瘍に対する防御作用(醫学と生物学. 124(2), 67-70, 1992)
ストレスをかけ、胃潰瘍を誘導したラットに、プロポリス散剤を投与した。
胃に生じた潰瘍の長さを測定、合計長を指標に評価を行った。
その結果、散剤に含まれるプロポリスエキスの濃度に依存して、胃潰瘍の形成が抑制されることがわかった。
以上より、プロポリスエキスにはストレス性胃潰瘍の形成抑制効果があることが示唆された。
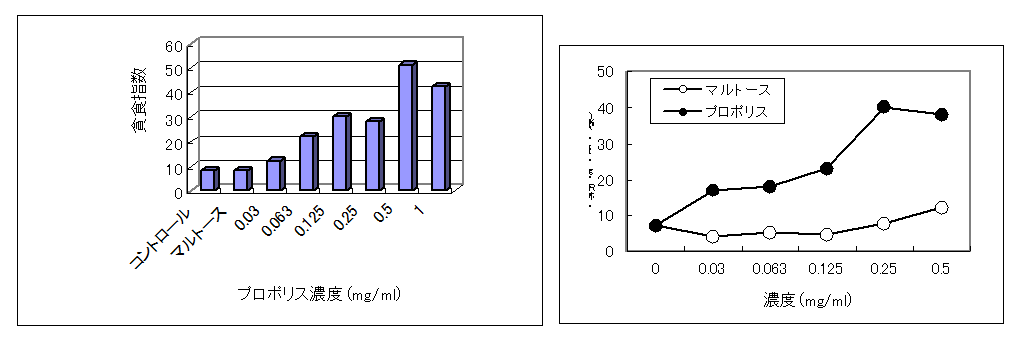
・プロポリスによるマクロファージ活性化作用(Biotherapy 7 (3), 364-365, 1993)
マウスMΦにプロポリス抽出エキスを添加すると、エキス濃度に比例してMfに特徴的な形態変化(伸展)が見られた。
また細菌や異物を取り込む作用(貪食作用)や、MΦが免疫監視役として、活発に動き回る作用(遊走能)もエキスの濃度依存的に増強された。
以上より、林原プロポリス抽出エキスは、抗菌作用や抗腫瘍作用などに関連した、MΦの免疫監視役としての機能を活性化することが示唆された。
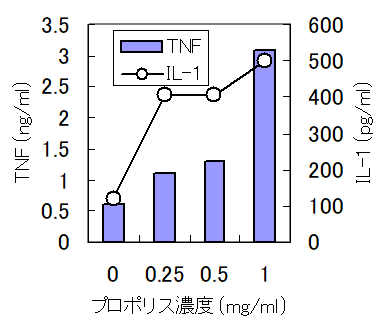
・プロポリスの免疫細胞からのサイトカイン産生増強作用(Biotherapy 8 (3), 346-347, 1994)
MΦにプロポリスエキスを添加すると、TNFとIL-1の産生はエキスの濃度依存的に増加したが、NOの産生は逆に抑制した。
この作用は、マウスにエキスを直接投与しても認められた。
この結果は、プロポリスの生体内免疫賦活化作用の一端を証明するものである。
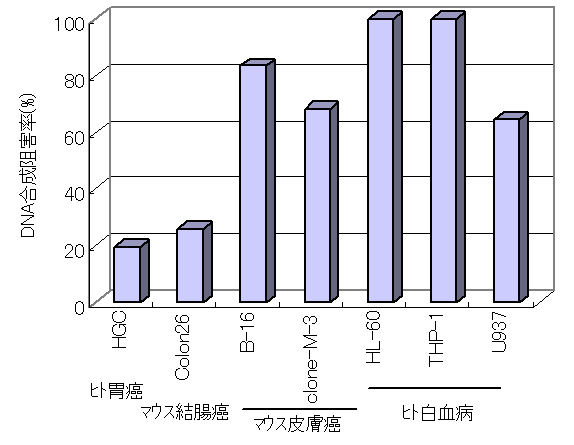
・プロポリスから抽出したアルテピリンCの抗癌・抗腫瘍作用とその機序(Cancer Detection and Prevention 22(6), 506-515, 1998)
培養癌細胞の増殖に与える直接作用について、癌細胞のDNA合成能を指標に検討した。
また、ヌードマウスの固形腫瘍モデルにてアルテピリンCの抗腫瘍作用を病理学的に検討した。
その結果、ヒト胃癌、マウス結腸癌、マウス皮膚癌、ヒト白血病細胞に対し、アルテピリンCはDNA合成阻害作用を示した。
また、ヌードマウスに移植した癌細胞の腫瘍内にアルテピリンCを投与することにより、癌の増殖は停止し、腫瘍の退縮が認められた。
以上から、アルテピリンCはDNA合成を阻害することによる抗癌・抗腫瘍作用が期待できると考えられた。
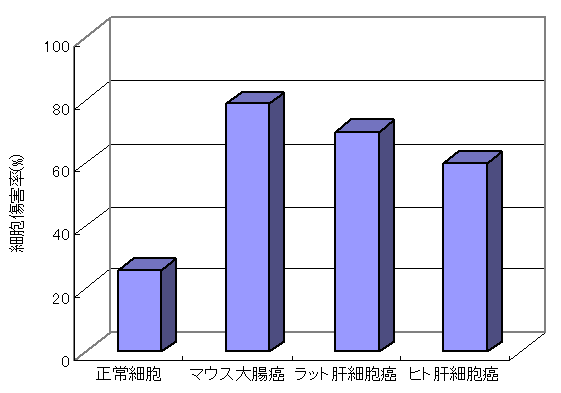
・細胞増殖が早い癌細胞に対するアルテピリンCの抗癌作用(癌と化学療法 23(13), 1855-1859, 1996)
プロポリス成分のアルテピリンCは細胞増殖速度の遅いマウス胎児脳由来正常細胞に対してほとんど増殖抑制作用を示さなかった。
一方、増殖速度が早いマウス大腸癌細胞、ラット肝細胞癌およびヒト肝細胞癌に対しては、著しい増殖抑制作用を示した。
この結果から、アルテピリンCは増殖能の高い、すなわち悪性度の高い癌細胞に対して特異的に作用し、増殖速度の遅い正常細胞への影響は少ないと考えられた。
以上より、アルテピリンCは、副作用の少ない抗癌作用を示す物質である可能性が考えられた。
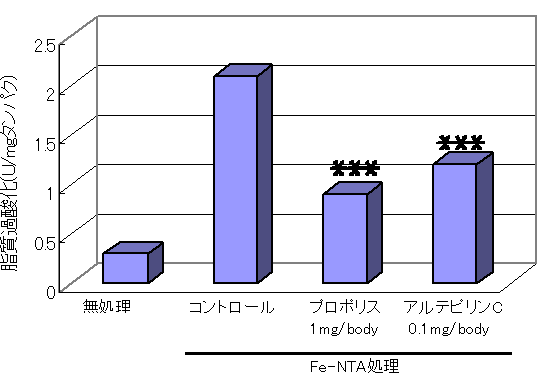
・プロポリスとアルテピリンCの経口投与による腎臓における発癌の抑制効果(Pathology International 50, 679-689, 2000)
プロポリスは2時間前投与で、アルテピリンCは投与時間に関係なく、Fe-NTA誘導脂質過酸化によるチオバルビツール酸反応産物 (TBARS) の増加を、用量依存的かつ有意に抑制した。 また、Fe-NTAの反復投与による腎障害や発癌に対し、プロポリス及びアルテピリンCは保護効果を示した。
・プロポリスの抗菌作用(医学と生物学 124(5), 205-209, 1992)
菌株には腸内細菌、放線菌を含むバクテリア42株、酵母4株、カビ8株の合計54株を使用し、プロポリスの抗菌作用を検討した。 代表的な結果をまとめ以下に示した。

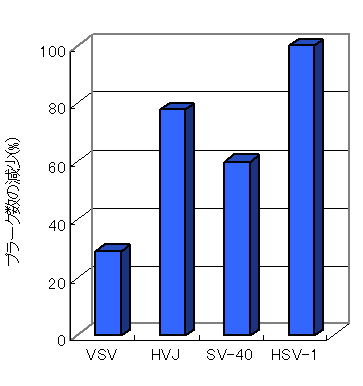
・プロポリスの抗ウイルス作用(生薬学雑誌 47(1), 60-64, 1993)
プロポリスエキスと各種ウイルスとを混合することにより、ウイルスの感染率(プラーク数)は低下し、プロポリスエキスに抗ウイルス作用が認められ、その作用は濃度依存的であった。
プロポリスエキス10μg/ml によるプラーク数減少率は、HVJが76.2 %、SV-40が61.1 %、HSV-1が100 %であり、強いウイルス不活化作用を示した。
特にヒトに感染するHSV-1では、エキス1μg/mlという低濃度でも100 %のプラーク減少率(不活化)が認められた。 なお、このプロポリスの作用は、ウイルスを直接的に不活化する作用であり、細胞に作用した結果としてウイルス感染を阻止する作用ではないと考えられた。 以上より、プロポリスには風邪などのウイルス感染症予防が期待される。
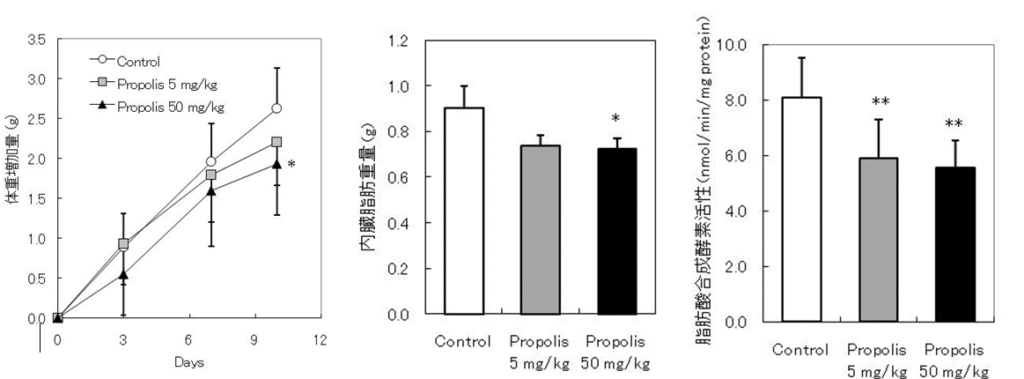
・プロポリス経口投与による食因性高脂血症の予防と体重増加軽減(Biol. Pharm. Bull. 32(12), 2022-2028, 2009)
高脂肪食開始時からプロポリスを投与したところ、10日後に体重増加が有意に抑制され、内臓脂肪重量が抑えられていた。
また、血清や肝臓に含有される脂質量も抑制されていた。
肝臓において脂肪酸合成酵素関連遺伝子の抑制が認められ、マウス肝臓抽出液を材料に測定を行った脂肪酸合成活性も抑制されていることがわかった。
以上より、プロポリス摂取が、食因性の体重増加の軽減と高脂血症の予防に有効であることが示唆された。その作用メカニズムの1つは肝臓での脂肪酸合成の抑制によるものと考えられる。
——中国パセリ——
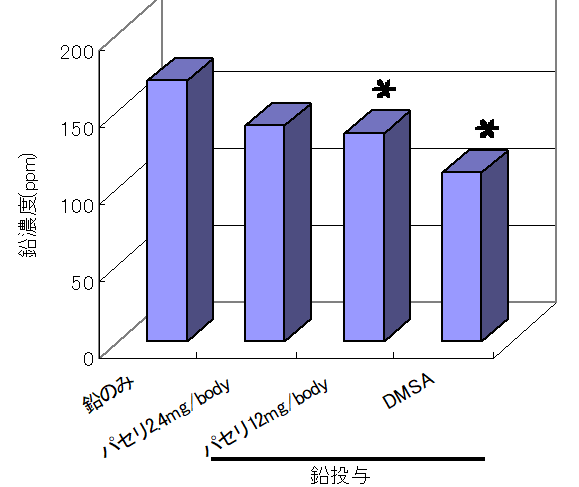
中国パセリの経口投与による鉛蓄積抑制作用(J. Ethnophamacol. 77, 203-208, 2001)
中国パセリ投与により、大腿骨に蓄積した鉛濃度が有意に減少した。
その際、カルシウム濃度に関しては、変化は認められなかった。
また腎臓における鉛蓄積量も減少傾向を示し、組織学的所見においても中国パセリ投与により腎臓組織変性抑制が認められた。
さらに、鉛毒性のマーカーである尿中ALA量も減少し、鉛中毒が中国パセリにより緩和されることがわかった。
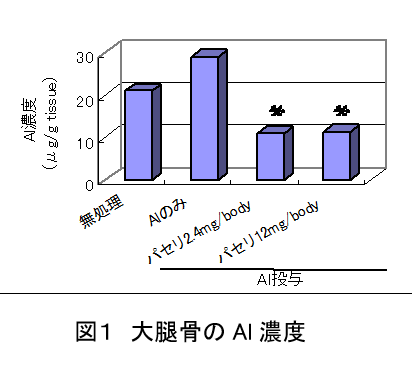
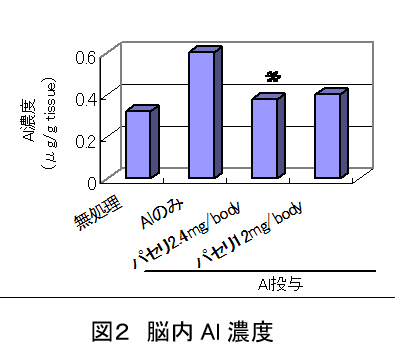
中国パセリの経口投与によるアルミニウム蓄積抑制作用(Natural Medicines 56(5), 187-190, 2002)
中国パセリ投与により、大腿骨に蓄積したAl濃度が有意に減少した。
また脳内に蓄積したAl蓄積量も減少した。
特に中国パセリ投与群の大腿骨内Al量は、Alを投与していないコントロールよりさらに低い傾向を示した。
従って、中国パセリはAl蓄積抑制作用以外に、すでに組織に蓄積されたAlを排泄する作用も有している可能性も示唆された。
——トレハロース(賦形剤)——
・トレハロースの経口摂取が腸管免疫系に及ぼす影響(J Health Science. 48(3), 282-287, 2002)
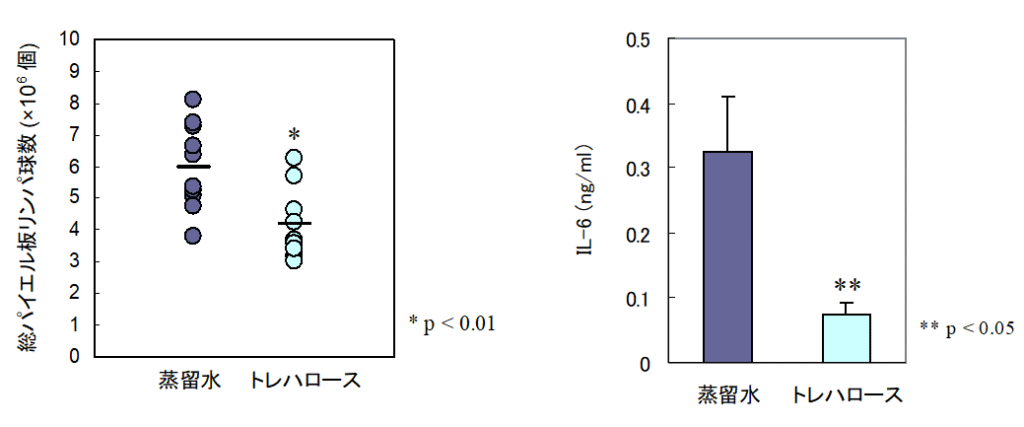
マウスにトレハロースを摂取させ、腸管免疫に重要な小腸パイエル板の変化を調べた。
その結果、トレハロース摂取マウスは、蒸留水摂取マウスよりも、パイエル板が小さく 、パイエル板リンパ球数が少なかった。
また、パイエル板リンパ球の産生するインターロイキン-6産生量も低かった 。
パイエル板は腸内環境が悪くなると、免疫を司るリンパ球が増加して発達する。
パイエル板を中心とした腸管免疫反応は全身に影響することが知られ、既にトレハロースのIL-6産生抑制を介した骨粗鬆症予防効果が報告されている。
これらのことから、トレハロースは腸内環境を改善すること、および腸管のIL-6産生抑制を介して骨粗鬆症予防に寄与している可能性が示唆された。
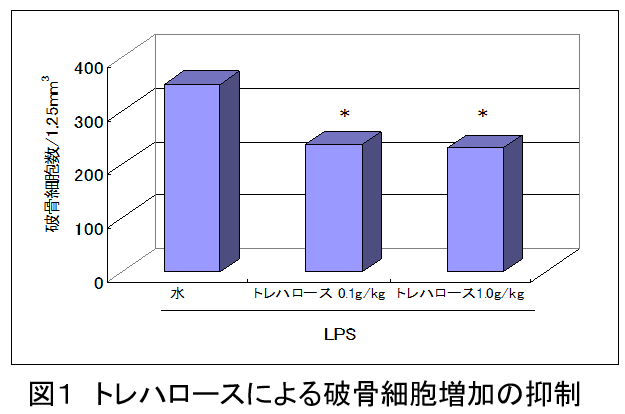
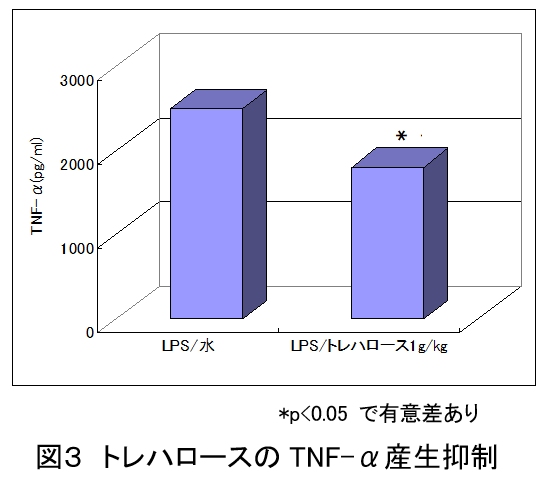
トレハロースの破骨細胞生成抑制作用(Nutrition Research, 21, 993-999, 2001)
トレハロースをマウスに経口投与後、バクテリア菌体抽出物を注射し、破骨細胞を誘導した。
LPS投与48時間後、トレハロース0.1g/kg、1g/kg投与群ともに大腿骨骨髄中の破骨細胞数の増加は有意に抑制された。
その際、トレハロース投与マウスでは血中TNF-αの量が水投与群に比べ、有意に抑制された。
以上より、トレハロースは破骨細胞を誘導するTNF-αの産生を抑制して、破骨細胞の増加を抑えることで骨粗鬆症に対する防御作用を持つと考えられた。
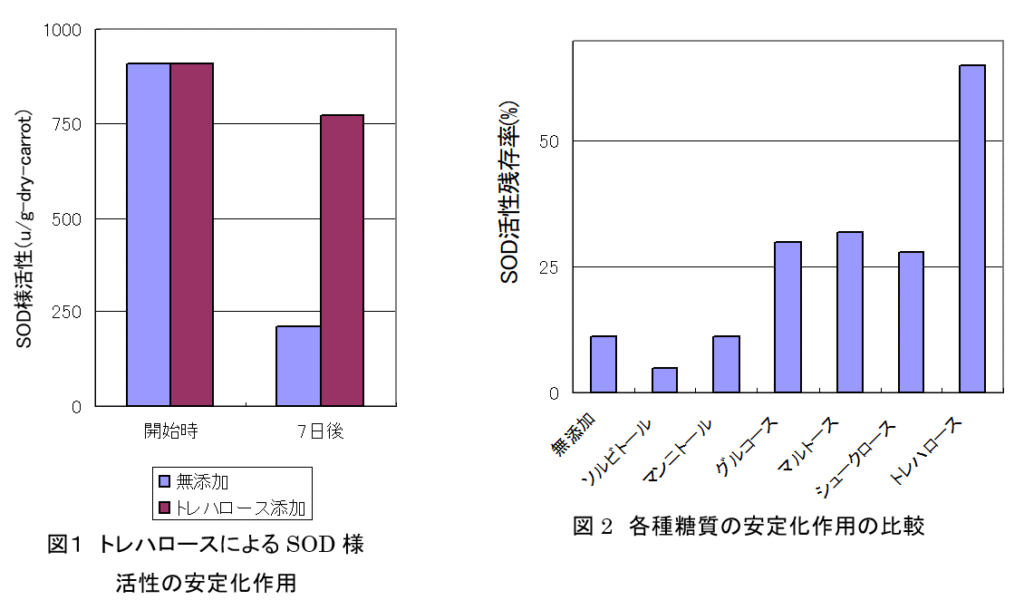
トレハロースによる野菜のスーパーオキシドジスムターゼ様活性の安定化(日本食品科学工学会誌. 45(3), 210-215, 1998)
人参の固形分に等量のトレハロースを混合し、40℃で40時間乾燥させて人参粉末を調製した。これをさらに40℃で7日間保存した後、残存するSOD様活性を測定した。
その結果、残存するSOD様活性はトレハロースを含まない人参だけの粉末よりも高かった。
また、トレハロースの作用をグルコースなどの他の糖質と比較したところ、トレハロースが最もSOD様活性を安定化させる効果が強かった。
以上より、スーパーオキシドを消去する作用の強い野菜を加工した食品や生薬の加工時にトレハロースを添加すれば、活性を安定化させることができると思われる。